El principio de exclusión de Pauli, fue desarrollado por el físico austriaco Ernst Pauli en el año 1925. Este principio de la cuántica dice que dos partículas ( concretamente fermiones) que tiene los números cuánticos con los que constan idénticos, no pueden existir.
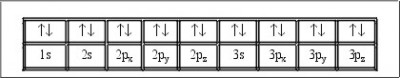
Esto significa que dos electrones ( fermiones) que se encuentren en un átomo no podrán poseer a la vez iguales números cuánticos. Este hecho explicaría que los electrones se dispersen en capas o niveles en torno al núcleo del átomo y por lo cual, los átomos que posean mayor número de electrones ocupen mayor espacio, debido a que aumenta el número de capas de las que consta el átomo. El número máximo de electrones que puede tener una capa o nivel es de 2n^2.
Para poder describir de forma completa al electrón dentro del átomo de hidrógeno, necesitamos introducir obligatoriamente un cuarto número cuántico a los ya conocidos. Dicho cuarto número cuántico se representa por las letras ms, y es conocido como el número cuántico de spin, el cual se encuentra relacionado estrechamente con las propiedades magnéticas que presentan los electrones. El número cuántico mas, tan sólo puede tener dos valores diferentes, +1/2 o -1/2. A los electrones cuyos valores de mas son iguales, se dice que cuentan con lo que se conoce como spines paralelos, sin embargo, si los valores que presenta mas son distintos se dice que poseen spines opuestos o también llamados antiparalelos.
No hay comentarios:
Publicar un comentario